
“重大专项”、“特殊审批”和“加快品种”一直被称作是创新药“开快车”的三大通道。
医药地理从国家食品药品监督管理总局药品审评中心的公开资料了解到,目前特殊审批品种共1370条记录,重大专项319条,现可查已上市品种共涉12个受理号。
“开快车”上市药品信息
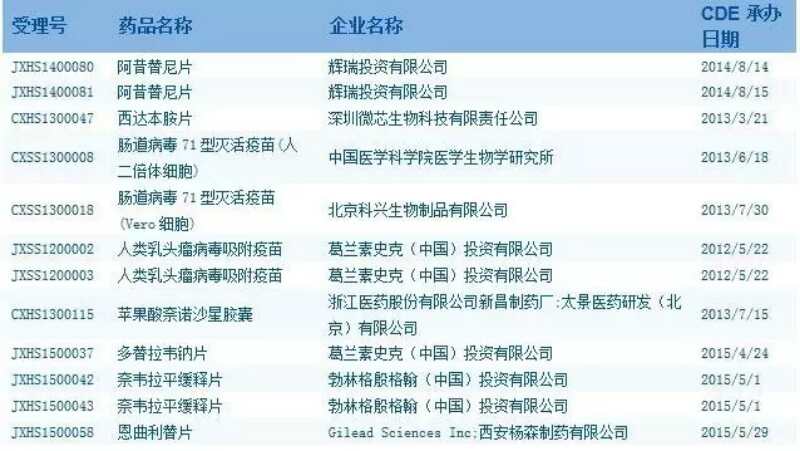
数据来源:国家食品药品监督管理总局药品审评中心官网
阿西替尼片
阿西替尼片(Inlyta)于2012年1月27日获得美国食品药品监督管理局批准,用于治疗其他药物治疗无效的晚期肾癌(肾细胞癌),并于2015年6月获CDE进口化药申请销售批准。根据中国医药工业信息中心PDB的监测数据,2016年前两个季度阿西替尼片国内重点城市医院销售额为295875元,由辉瑞巨头全揽,相比2015年全年增长114.29%。
西达本胺片
西达本胺属苯酰胺类化合物,为一种组蛋白去乙酰化酶(HDAC)抑制剂。HDAC抑制剂为现下全球药物研发热点,全球各大企业争相投入巨大热情意在分得一杯羹,我国企业当然不能坐失机会。
国外HDAC抑制剂竞争情况

深圳微芯生物科技自主研发的西达本胺片,于2006年11月30日获得I期临床批件,2009年2月10日获得II/III期临床批件进行淋巴瘤(CTCL和NHL)的临床研究。2013年2月完成II期临床试验,按化药注册分类1.1申报生产。申报的适应症为既往治疗后复发或难治性外周T细胞淋巴瘤(PTCL)。2015年1月获得国内化药新药生产批准。据PDB显示,2016年1、2季度,西达本胺片重点城市销售数据为26410元,已完成2015年的67%。
肠道病毒71型灭活疫苗(人二倍体细胞)/(Vero细胞)
肠道病毒71型灭活疫苗(人二倍体细胞)和肠道病毒71型灭活疫苗(Vero细胞)主要用于预防6个月以上易感者EV71引起的手足口病。两者均享受了特殊审评程序加快审评的“快车道”待遇。
中国医学科学院医学生物学研究所自2008年开始EV71灭活疫苗的研发工作,卫生计生委将其纳入国家重大新药创制科技重大专项予以支持,并于2015年12月获得国内生物制品新药申请生产批准。
由北京科兴中维生物技术有限公司申报生产的肠道病毒71型灭活疫苗(Vero细胞)于2016年1月获批,肠道病毒71型灭活疫苗(人二倍体细胞)迎来劲敌,同时掀起国内研发的一波热潮。另外,国外尚无同类产品上市。
肠道病毒71型灭活疫苗国内研发情况
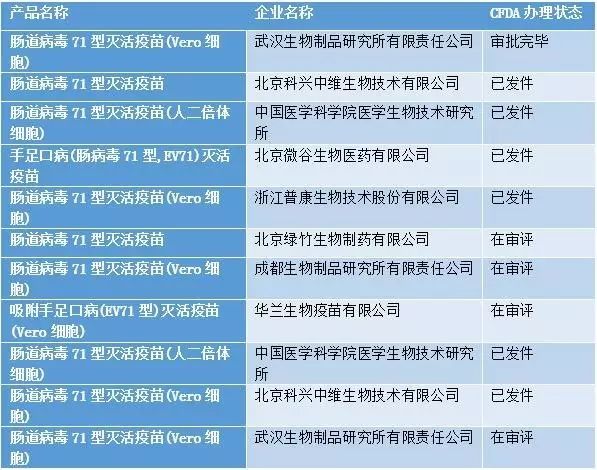
数据来源:中国医药工业信息中心CPM数据库
人类乳头瘤病毒吸附疫苗
人类乳头瘤病毒吸附疫苗主要用于预防由包含致癌型乳头瘤病毒引起的生殖器(宫颈、外阴和阴道)癌前病变和子宫颈癌。目前,国外已有3种HPV疫苗获准上市使用。其中葛兰素史克的2价(HPV16、18)和默沙东研发4价(HPV6、11、16、18)HPV疫苗均已在包括美国和欧盟等多个国家和地区上市。默沙东在4价HPV疫苗基础上研发的9价HPV(HPV6、11、16、18、31、33、45、52、58)疫苗已于2014年12月在美国获准上市。
在国内,葛兰素史克的2价(HPV16、18)HPV疫苗于2016年7月获得进口生物药新药申请销售批件。但葛兰素史克面临的压力恐怕也不小。根据中国医药工业信息中心CPM数据库的监测数据,目前国内已有厦门万泰、上海泽润等获准进行临床试验,尚有多家研发企业申请不同HPV型别组成的HPV疫苗临床试验。
人类乳头瘤病毒吸附疫苗国内申报趋势
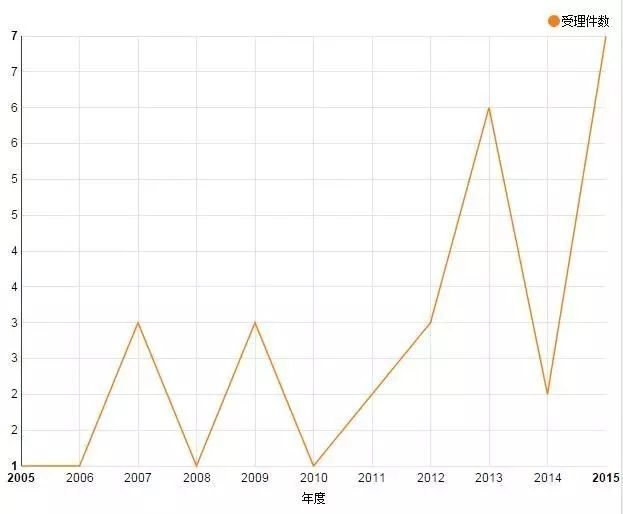
数据来源:中国医药工业信息中心CPM数据库
苹果酸奈诺沙星胶囊
苹果酸奈诺沙星为不含氟的喹诺酮类抗菌药,通过抑制细菌DNA回旋酶的活性而抑制细菌DNA复制。它由美国宝洁医药公司研发,授权太景医药研发(北京)有限公司在中国开发,并由浙江医药股份有限公司新昌制药厂生产。
自2013年按创新药申请上市并加快审批以来,2016年6月其终于等来了化药新药申请生产批件。从国内研发受理号数量来看,太景医药的主要对手是华裕(无锡)制药,另外海门慧聚药业也已获得临床申请。
多替拉韦钠片
多替拉韦钠片是一种新型且有效的选择性、可口服应用的整合酶抑制剂(INI),是一种较新的HIV治疗药物。它于2013年8月12日首次被美国FDA批准上市,2014年1月21获得EMA批准。根据中国医药工业信息中心PDB数据库,2015年多替拉韦在国外斩获了20.86亿美元的销售额。
2016年1月,多替拉韦钠片获得进口化药申请销售批件。在国内整合酶抑制剂销售市场,其核心竞争来自默沙东的拉替拉韦(商品名为艾特生)。受业界看好,多替拉韦钠片预计在华也能取得一份漂亮的成绩单。
奈韦拉平缓释片
奈韦拉平是一类强效非核苷类HIV-1逆转录酶抑制剂。勃林格殷格翰为奈韦拉平的原研企业。奈韦拉平片剂最初于1996年6月在美国通过加速批准措施获得批准,现片剂和口服混悬剂分别在74和21个国家获得批准。目前国内市场还有奈韦拉平胶囊和分散片,但尚无其他厂家的缓释片上市。
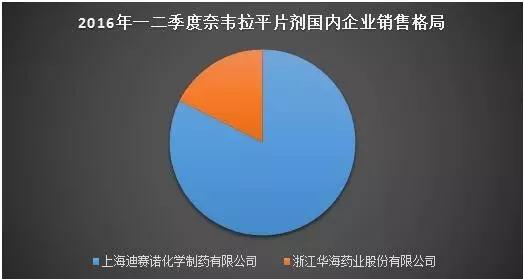
数据来源:中国医药工业信息中心PDB数据库
奈韦拉平缓释片2011年6月在美国获得批准,2011年9月在欧洲获得批准。2015年5月申请中国境内进口销售,因属抗HIV药物获得快审评资格,在不到一年的时间里,于同年11月获批。从政策来看,目前抗病毒药物领域多个新药获批,市场关注度在不断提高,这给奈韦拉平缓释片在中国的销售带来利好。但也有声音表示,由于艾滋病治疗国家是最重要的买单方,因此,奈韦拉平短期内的国内市场不会太乐观。
恩曲利替片
恩曲利替片是恩曲他滨、富马酸替诺福韦二吡呋酯、盐酸利匹韦林三方的复方制剂。目前美国、欧盟及中国均已批准恩曲他滨(国内上市的恩曲他滨非原研,2005年上市)、盐酸利匹韦林(2012年原研进口)和富马酸替诺福韦酯(2008年原研进口)单方制剂上市。
Gilead 的恩曲利替片于2004年8月获FDA批准上市,2005年2月获EMA批准上市,2012年获准进口中国,用于治疗HIV-1感染。2016年1月获批在中国上市,速度惊人。而它在销售方面是否会持续发力,值得业界期待。
浙ICP备16016599号