
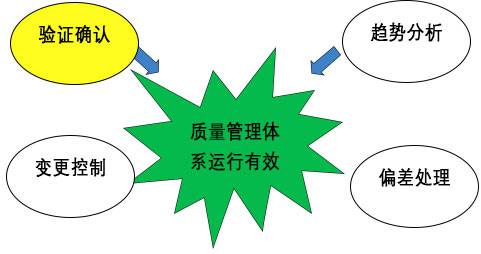
保证药品质量是GMP期望的结果,而做好设备确认和验证工作是前提。
我们都知道,设备是为生产服务的,产品某些工艺的实现需要以设备为依托,这就对设备提出了明确和具体的要求。
在2010版GMP就对确认和验证添加了明确要求:
在第7章从第138条至第149条都是关于确认与验证的介绍。范围包括设备设施确认、工艺验证、清洗验证等。其中:
第138条:企业应当确定需要进行的确认或验证工作,以证明有关操作的关键要素能够得到有效控制。确认和验证的范围和程度应当经过风险评估来确定。
第139条:企业的厂房、设施、设备和检验仪器应当经过确认,应当采用经过验证的生产工艺、操作规程和检验方法进行生产、操作和检验,并保持持续的验证状态。
第140条:应当建立确认与验证的文件和记录,并能以文件和记录证明达到以下预定的目标:
(1)设计确认应当证明厂房、设施、设备的设计符合预定用途和本规范要求;
(2)安装确认应当证明厂房、设施、设备的建造和安装符合设计标准;
(3)运行确认应当证明厂房、设施、设备的运行符合设计标准;
(4)性能确认应当证明厂房、设施、设备在正常操作方法和工艺条件下能够持续符合标准;
(5)工艺验证应当证明一个生产工艺按照规定的工艺参数能够持续生产出符合预定用途和注册要求的产品。

从源头上切断药物的危险因素,保证药物的质量,展开设备确认工作是企业需要重视的。目前各企业对设备确认工作了解多少?知道如何正确开展工作吗?化工邦联合中国药科大学 针对这些问题给出了对策,帮助企业做好设备验证工作,达到GMP标准。
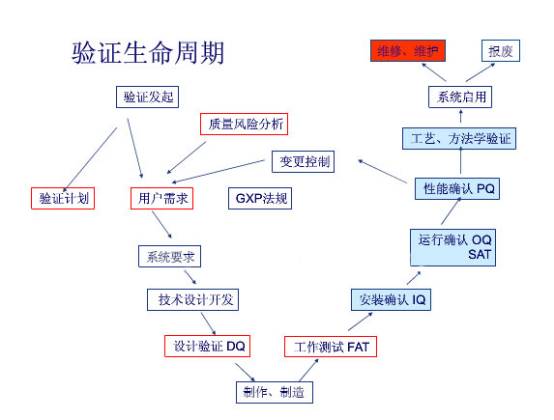
先介绍下什么是设备验证和设备设计确认
设备验证是指对生产设备的设计、选型、安装及运行的正确性以及工艺适应性的测试和评估,证实该设备能达到设计要求及规定的技术指标。
设计确认(以下简称DQ)又称预确认,是设备验证工作的第一步,是指制药企业评价设备技术指标并遴选最优设备供应商的过程。
也就是说,企业要进行设备验证,就是先根据药品生产工艺的设计情况,对生产所用的设备进行设计和选型。一般是参照说明书从设备的性能及设定的参数等方面进行考查。最后由企业相关部门写出验证报告,经审核批准,最后选定设备供应厂商。
再来说说如何开展设计确认(DQ)工作
2010版GMP第一次引入了风险评估概念,在第七章还要求“确认和验证的范围和程度应当经过风险评估来确定”。
所以要展开DQ工作首先是要对工艺设备进行风险分析,然后形成用户需求标准URS。
一般的,从工艺出发,确定设备验证范围有如下几类:1)对工艺路线图上所有的设备做风险分类。2)直接或间接影响药品质量的,或与生产工艺过程、质量控制、环境、安全和数据真实性等相关的设备做验证。3)依据设备用途和工艺要求等对这类设备做风险分析。
做好风险分析后,还需编制符合本公司的URS。强调制药设备应满足药品生产企业的需求,以及用户对产品性能、技术、使用、服务等的要求。而风险评估也应作为URS的内容在合同中明确提出。
可以说,DQ工作就是对URS各项要求的确认,URS中的各项陈述就是DQ工作的接受标准。因此,一份编写良好的URS是DQ顺利进行的必要条件。
GMP的核心思想之一就是“药品的质量不是检验出来的,是生产出来的,更是设计出来的”,这个“设计”既包括生产工艺设计,同时也是与生产工艺密切相关的制药设备的设计。
制药企业必须认识到设计确认是制药设备验证工作中最基础也是最重要的一环,那么接下来需要根据生产工艺对设备的功能、材质、结构的特定要求开展设计确认工作:
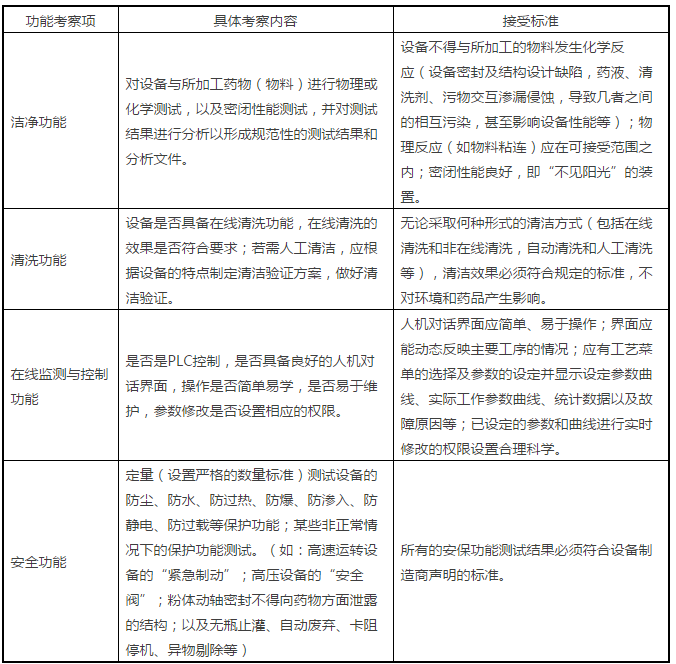
1、设备功能确认
由于药品生产的特殊性,制药企业宜从设备的洁净功能、清洗功能、在线监测与控制功能以及安全保护功能进行分析。具体考察内容详见表1。
表1:设备功能确认项目表
2、设备材质确认
GMP规定制造设备的材料不得对药品性质、纯度、质量产生影响,其所用材料需具有安全性、辨别性及使用强度。可分为:
(1)在药物等介质的腐蚀性,接触性,气味性的环境条件下不发生反应,不释放微粒,不与所生产的药物或有要求的工艺介质发生化学反应或吸附。
(2)对于金属材料,凡与药物及腐蚀性介质接触的以及潮湿环境下工作的均应选用低含碳量的不锈钢材料、钛及钛复合材料或铁基涂覆耐腐蚀、耐热、耐磨等涂层的材料制造。
(3)非金属材料的选择原则是无毒性、耐腐蚀,即:不应是松散状的、掉渣、掉毛的,特殊用途的还应结合材料的耐热、耐油、不吸附、不吸湿等性质考虑选用,密封填料和过滤材料尤应注意卫生性能的要求。
3、设备结构确认
设备的结构具有不变性,一旦投入使用不合理、不适用的设备,要做更改几乎是不可能的。因此,设备的结构对生产的影响是先决的,对设备结构的考察也是DQ工作的重中之重,设备结构的确认可根据表2展开。
表2:设备结构确认考察表

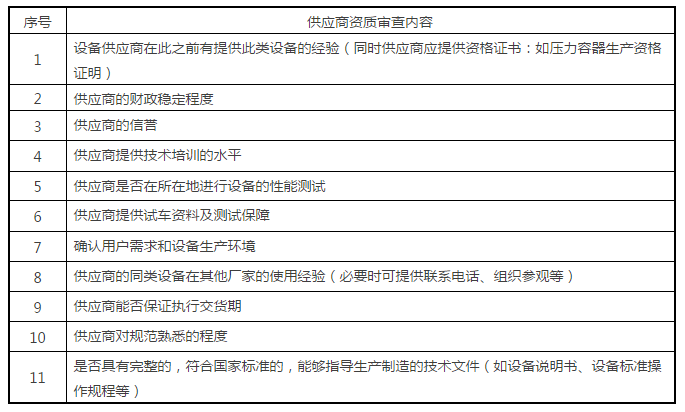
最后说一下设备供应商的遴选。在确定设备的关键参数后,接下来的工作就是根据产品工艺属性和设备关键参数遴选出最优的设备供应商。具体可从以下几方面开展(表3):
表3:供应商资质审查
在确定设备供应商后,应对设备供应商的质量保证体系进行现场审查。检查设备的技术文件(如:P&ID,施工图等)是否考虑到用户要求标准(URS)及GMP的要求,设备所用的材质、结构、外观、功能性能是否符合产品质量标准。
此外,制药企业还应参与设备制造商的工厂验收试验(FAT),并详细记录各项试验数据,为之后设备进入生产现场后进行的SAT,IQ,OQ,PQ等工作做好铺垫。
结语:
验证不是目的,只是产品质量的保障。提升技术装备水平,提高设备风险评估和URS的水平,才能生产出质量合格的药品,这个是前提,是基础。对设备确认工作的各项也要按照标准严格执行。
化工邦声明:化工邦发布此文出于传递更多信息之目的,并不意味着赞同其观点或证实其描述。文章内容仅供参考,欢迎交流补充。请联系化工邦微信:CHEMBANGPUB和QQ:2928245548。投稿详情请点击“《邦学堂》上线啦!快来学习和分享|欢迎投稿!”
推荐单位:中国药科大学:
中国药科大学药品国内外注册与质量管理研究培训中心是一支专业能力强、年富力强,人员素质高,责任心强的团队,常驻企业一线,拥有丰富的实战经验。在仿制药一致性评价方面,中国药科大学仿制药一致性评价研究中心由4名教授、3名副教授、十余名从业近20年医务临床研究人员以及三十余名硕博士研究生组成。本团队还与中国科学院上海药物所、南京大学、南京医科大学、南京中医药大学、南京师范大学等兄弟院校相关研究团队密切合作。【详情点击(【震撼来袭】化工邦联合中国药科大学,为医药化工企业转型升级谋福利,大波重磅资源为邦友开启)】
浙ICP备16016599号